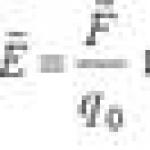Липосомы представляют собой в некотором роде прообраа клетки. Они служат моделью для исследований рааличных свойств клеточных мембран.
Липосомы нашли непосредственное применение в медицине. Например, можно ааключить внутрь липосом лекарственный препарат и испольаовать как фосфолипндную мнкрокапсулу для доставки лекарства в определенные органы и ткани. Липосомы не токсичны (при правильном подборе липидов), полностью усваиваются органиамом, способны преодолевать некоторые биологические барьеры. Так, инсулин, ааключенный в липосому, аащищен от действия пищеварительных ферментов. В настоящее время выясняется воаможность вводить этот препарат в липосомах перорально, что может набавить больных диабетом от необходимости систематических уколов. Проводятся работы по рааработке методов лнпосомальной терапии опухолей, ферментативной недостаточности, атеросклероаа. Научается воаможность прицельной доставки лекарственного препарата, ааключенного в липосомах, к больному органу или даже к больному участку (в частности, к пораженному участку сердца).
Для этого к липосоме присоединяется белковая молекулаантитело к соответствующему мембранному антигену органа-мишени. Липосомы с током крови рааносятся по всему органиаму и аадерживаются, окааавшись около органа-мишени.
Несмотря на ааманчивые перспективы липосомальной терапии, еще имеется достаточно много нерешенных вопросов. Ы ~Уре
с Ряс. 1. 12. Обраэование плоской бислойной лилианой мембраны
Плоские биелойиые липидиые мембраны (БЛМ) - другой тип модельных мембран. Такие мембраны получают иа маленьких отверстиях диаметром около 1 мм в пластинке ив пластика (например, фторопласта), погруженной в водную среду. На отверстие наносят каплю раствора липида (в спирте, хлороформе, гептаие или других растворителях). Раствори- тель диффундирует ив раствора в воду, и иа отверстии остается пленка липида. Эта плевка спонтанно утончается до тех пор, пока не обраэуется бимолекулярный слой толщиной около 6 нм. Лишний линия собирается в виде ободка-торуса у краев отверстия (рис. 1.12).
Плоские липидные мембраны, наряду с липосомами, широко испольэуются в качестве моделей для научения электрических свойств мембраны, их проницаемости и других научных исследований. С помощью модельных мембран научают ряд функций биологических мембран, а том числе, барьерную (например, селективность проницаемости - хорошую проницаемость для воды и плохую для ионов). Можно моделировать биологический транспорт, вводя в модельную мембрану молекулы-переносчики.
КОНТРОЛЪНЫВ ВОПРОСЫ, ЗАДАЧИ, ЗАДАНИЯ
1. Удельная электрическая емкость мембраны аксона, немеренная внутриклеточным микроэлектродом, окаэалась равной 0,5 микрофарад/см". По формуле плоского конденсатора оценить толщину гидрофобиого слоя мембраны с диэлектрической проницаемостью 2.
2. Какое расстояние на поверхности мембраны эритроцита проходит молекула фосфолнпида эа 1 секунду в реэультате латеральной диффуэииу Коэффициент латеральной диффуэии принять равным 10 1э м"/с. Сравните с окружностью эритроцита диаметром 8 мкм.
3. При фаэовом переходе мембранных фосфолипидов иэ жидкокристаллического состояния в гель толщина бислоя иэменяется. Как при этом пепелится электрическая емкость мембраныу Как иэменится напряженность электрического поля в мембранеу
4. С помощью спин-меченых молекул фосфолипидов установлен градиент вяэкости по толщине мембраны. Опишите эксперимент. Где вяэкость выше: у поверхности мембраны или в ее центреу
1. Отсюда был сделан вывод, что мембрана эритроцитов состоит из липидных молекул, расположенных в два слоя.
По-видимому, этот вывод Гортера и Грендела оказался правильным только благодаря взаимной компенсации ошибок, однако в историческом плане эта работа имела большое значение, поскольку с тех пор концепция липидного бислоя как структурной основы биологических мембран стала доминирующей и на самом деле оказалась верной.
Концепция бимолекулярной липидной мембраны получила дальнейшее развитие в предложенной в 1935 г. модели Дэвсона-Даниелли, или модели "сэндвича", в которой предполагалось, что белки покрывают поверхность липидного бислоя. Это была необыкновенно удачная модель, и в течение последующих 30 лет многочисленные экспериментальные данные, особенно полученные с помощью дифракции рентгеновских лучей и электронной микроскопии, полностью подтвердили ее адекватность. Однако тогда же обнаружилось, что мембраны выполняют огромное множество функций, и чтобы объяснить этот феномен, исходная модель Дэвсона-Даниелли неоднократно подвергалась модификациям.
Быстрый прогресс в мембранологии, в результате которого сформировались современные представления, был достигнут в значительной мере благодаря успехам в изучении свойств мембранных белков. Электронно-микроскопические исследования с применением метода замораживания-скалывания показали, что в мембраны встроены глобулярные частицы. Тем временем биохимикам с помощью детергентов удалось диссоциировать мембраны до состояния функционально активных "частиц". Данные спектральных исследований указывали, что для мембранных белков характерно высокое содержание а-спиралей и что они, вероятно, образуют глобулы, а не распределены в виде монослоя на поверхности липидного бислоя. Неполярные свойства мембранных белков наводили на мысль о наличии гидрофобных контактов между белками и внутренней неполярной областью липидного бислоя. Тогда же были разработаны методы, позволившие выявить текучесть липидного бислоя. Сингер и Николсон свели воедино все эти идеи, создав жидкостно-мозаичную модель. В рамках этой модели мембрана представляется как текучий фосфолипидный бислой, в который погружены свободно диффундирующие белки. Прежняя модель Дэвсона-Даниелли была статичной и успешно объясняла имевшиеся в то время структурные данные, полученные с довольно низким разрешением. В то же время начиная с 1970 г. большое внимание стало уделяться изучению динамических свойств и их взаимосвязи с мембранными функциями. В последние годы жидкостно-мозаичная модель тоже подверглась модификации, и этот процесс будет продолжаться. В частности, теперь стало ясно, что не все мембранные белки свободно диффундируют в жидком липидном бислое. Имеются данные о существовании латеральных до-j менов в самой мембране. Тщательно изучается также роль цитоскелета. Становится все очевиднее, что некоторые участки мембран, по-видимому, отличаются по своей структуре от классического липидного бислоя. Тем не менее в обозримом будущем жидкостно-мозаичная модель в ее разных модификациях будет служить в качестве концептуальной основы для многих мембранных исследований.
3. Морфология мембран
Важную роль в выяснении морфологии мембран сыграли два метода: дифракция рентгеновских лучей и электронная микроскопия. Именно с их помощью была подтверждена правильность бислойной модели. Однако следует иметь в виду, что при выяснении детальной картины молекулярной организации мембран оба этих метода сталкиваются с рядом ограничений.
3.1 Дифракция рентгеновских лучей
При исследовании высокоупорядоченных кристаллических образцов с помощью метода дифракции рентгеновских лучей удается получить информацию о структуре с высоким разрешением. В случае же малоупорядоченных препаратов возможности этого метода ограничены. Некоторые специализированные мембранные системы уже имеют регулярную структуру, и потому их можно изучать рентгено-структурными методами. Примером такого рода служит миелиновая оболочка периферических нервных волокон; она представляет собой мембрану, которая, многократно оборачиваясь вокруг аксона, формирует регулярную систему из концентрических мембранных структур. Исследования дифракции рентгеновских лучей на миелине, проведенные еще в 30-х гг., подтверждают адекватность бислойной модели мембран. К такому же выводу приводит и изучение наружного сегмента палочек сетчатки позвоночных, которые представляют собой природные упорядоченные мембранные системы, а также искусственно упорядоченных систем, которые образуются при коллапсировании в условиях центрифугирования мембранных везикул, полученных из митохондрий и эритроцитов. Во всех этих случаях наблюдалось сходное распределение электронной плотности в мембране, показанное на рис.1.4
Для интерпретации рентгеноструктурных данных необходимо определить не только интенсивности рефлексов, но и их фазы. В случае регулярно упакованных мембранных систем задача значительно упрощается, поскольку эти системы состоят из повторяющихся элементов с центральной симметрией.

Полученные данные показывают, что структура всех мембран сходна: они имеют гидрофобную внутреннюю область с низкой электронной плотностью и два слоя полярных группировок с высокой электронной плотностью. Рентгеноструктурные данные, полученные для разных мембран, различаются лишь незначительно, несмотря на большие различия в содержании в них белка. Хотя рентгеноструктурные данные позволяют получить некоторую информацию о том, как расположена в мембране основная масса мембранных белков, в целом метод рентгеноструктурного анализа не дает детальной молекулярной картины.
Уилкинс и др. отметили в 1971 г., что метод дифракции рентгеновских лучей можно использовать и для изучения водных дисперсий мембран и фосфолипидов. При этом рефлексы, порождаемые полярными областями на обеих сторонах бислоя, позволяют найти его толщину, равную расстоянию между полярными головками, а по рефлексам, порождаемым упорядоченными углеводородными цепями, можно определить расстояние между этими цепями. И в этом случае мембранные препараты, полученные из разных источников, дали сходную дифракционную картину, что подтверждает универсальность бислойной модели.
Невозможность получения с помощью метода дифракции детальной молекулярной картины ограничивает применение этого метода для изучения биологических мембран. Однако он может быть весьма полезен при исследовании упорядоченных липидно-водных систем.
3.2 Электронная микроскопия
Просвечивающая электронная микроскопия тонких срезов миелина, а фактически и всех остальных мембран, выявляет характерную трехслойную структуру, состоящую из двух электроноплотных полос, разделенных промежутком около 80 А. Такая картина получается в значительной мере в результате обработки препаратов четырехокисью осмия, обычно применяемой в этом методе. Робертсон назвал наблюдаемую структуру "унитарной", чтобы подчеркнуть ее универсальность, и хотя молекулярные механизмы прокрашивания мембран осмием неизвестны, эта структура рассматривалась как подтверждение справедливости бислойной модели мембраны. Ясно, однако, что при подготовке препаратов для просвечивающей электронной микроскопии мембраны могут подвергаться неблагоприятным воздействиям. В частности, известно, что обработка четырехокисью осмия приводит к значительной потере белка из эритроцитарной мембраны. И хотя наблюдаемая при этом трехслойная структура в некоторой степени отражает организацию бислойных мембран, более детальные сведения относительно локализации белков этим методом получить не удается.
Некоторую информацию о расположении мембранных белков дали новые методы, ставшие теперь уже "классическими", - методы замораживания-скалывания и замораживания-травления. В этих случаях препараты быстро замораживают, не подвергая их при этом каким-либо повреждающим воздействиям, как при получении тонких срезов. Процесс подготовки препарата включает следующие операции.
После замораживания образец, представляющий собой суспензию клеток или мембран, скалывают с помощью ножа при низкой температуре в глубоком вакууме. Возникающие при скалывании усилия приводят к образованию среза, проходящего через образец. Оказалось, что, когда плоскость среза проходит через мембрану, последняя раскалывается преимущественно по своей срединной области и расщепляется на две половинки. В результате на образовавшихся плоскостях скола обнажается внутренняя область мембраны.
При необходимости образец подвергают травлению - проводят обычную возгонку льда в вакууме. Это позволяет лучше визуализировать поверхностные структуры клеточных мембран.
После этого получают так называемую реплику с обнаженной поверхности. Именно эту реплику и изучают под электронным микроскопом. Для получения реплики сначала напыляют на образец платину под углом около 45°, чтобы выявить топологические характеристики препарата. Затем платиновой реплике придают механическую прочность, нанеся на нее слой углерода. После этого препарат оттаивают, реплика всплывает, и ее вылавливают с помощью специальной сеточки.

Наиболее характерные структуры, наблюдаемые при изучении мембран методом замораживания-скалывания, - это многочисленные внутримембранные частицы диаметром от 80 до 100 А, лежащие в плоскости мембранных сколов. Обычно они расположены хаотично, но иногда образуют группы. Многочисленные исследования показали, что эти частицы, возможно, являются мембранными белками. Любопытно, что при электронной микроскопии тонких срезов подобные структуры не обнаруживаются. Реплики, полученные от двух половинок расщепленной мембраны, не всегда бывают топологически комплементарными. Это означает, что некоторые частицы связаны только с одной из половин мембраны. Данные, полученные методом замораживания-скалывания, широко использовались Сингером и Николсоном при создании жидкостно-мозаичной модели мембран, поскольку они убедительно показывали, что глобулярные белки находятся не только на поверхности мембраны, но и внутри бислоя.
На рис.1.6 приведена электронная микрофотография препарата протеолипосом, реконструированных из яичного фосфатидилхолина и нефракционированного препарата белка полосы 3 из мембраны эритроцитов человека; препарат получен методом замораживания - скалывания.
Белок полосы 3 является основным белковым компонентом мембраны эритроцитов и, как известно, осуществляет перенос анионов. Если фосфолипидные везикулы не содержат этого белка, то полученные препараты замороженных сколов имеют гладкую поверхность.
При встраивании белка полосы 3 в фосфолипидные везикулы на сколах появляются внутримембранные частицы, практически неотличимые от частиц, наблюдаемых в мембранах эритроцитов. Более того, при рН 5,5 частицы, наблюдаемые в мембране эритроцитов, агрегируют, причем эта агрегация осуществляется в результате взаимодействия белка полосы 3 с двумя другими белками, спектрином и актином.
Последние являются компонентами цитоскелета, находящимися на внутренней поверхности эритроцитарной мембраны. Аналогичным образом ведет себя и реконструированная система, состоящая из белка полосы 3 и фосфатидилхолина, при этом агрегация частиц наблюдается в присутствии спектрина и актина при рН 5,5, но не при рН 7,6.

Эти данные еще более упрочили представление о мембранных белках как о глобулярных частицах, свободно перемещающихся в плоскости мембраны. Интересно, что статичные микрофотографии препаратов, полученных методом замораживания-скалывания, помогли исследователям в изучении динамических свойств мембран. Как мы увидим, в мембранах есть много белков, которые не могут свободно плавать в "липидном море".
4. Выделение мембран
В течение последних трех десятилетий становилось все более очевидно, что огромное большинство клеточных функций осуществляется при непосредственном участии мембран.
И растительные, и животные клетки разделены на отсеки, причем многие цитоплазматические органеллы, как было показано в разд.1.1, имеют мембранную природу.
Кроме органелл, характерных для большинства клеток, имеются и специализированные мембранные системы, такие, как саркоплазматический ретикулум мышечных клеток, миелиновая оболочка периферических нервных волокон, тилакоидные мембраны хлоропластов и мембраны дисков в палочках сетчатки. У прокариотических организмов также имеются мембраны, хотя и не настолько развитые, как у эукариотических.
Грамположительные бактерии, например Bacillus subtilis, имеют лишь цитоплазматическую мембрану, а грамотрицательные, такие, как Escherichia coli, - еще и наружную, расположенную поверх тонкой пептидогликановой клеточной стенки.
В клетках прокариот обнаружены также некоторые специализированные органеллы. Некоторые вирусы, патогенные для животных, например вирусы с оболочкой, имеют самую настоящую мембрану, причем такие мембраны оказались чрезвычайно интересными для изучения.
Исследование мембран, как правило, сопряжено с их очисткой, при этом для каждого типа мембран характерны свои условия препаративного выделения.
Так, если предстоит исследовать плазматическую мембрану каких-либо клеток, то сначала необходимо выделить эти клетки из ткани. Затем нужно подобрать оптимальные условия разрушения клеток и отделения мембран, представляющих интерес, от других клеточных компонентов. Особого внимания заслуживают критерии чистоты выделенных мембран.
4.1 Разрушение клеток
Желательно выбирать такую методику, которая позволяет эффективно разрушить сами клетки при сохранении структуры мембран, подлежащих выделению. Для многих животных клеток можно использовать такую относительно мягкую процедуру, как гомогенизация в гомогенизаторах Даунса или Поттера-Элвехейма со стеклянными стенками и тефлоновым пестиком. При этом клетки разрушаются за счет сдвиговых усилий, возникающих при продавливании суспензии через узкий зазор между тефлоновым пестиком и стеклянной стенкой гомогенизатора. При такой обработке "срывается" плазматическая мембрана и разрушаются связи между различными органеллами при сохранении целостности самих органелл. С помощью такой процедуры можно также отделить друг от друга специализированные участки плазматической мембраны, например ба-золатеральную или апикальную области мембраны эпителиальных клеток. Желательно работать в условиях, когда целостность органелл сохраняется, чтобы свести к минимуму возможность высвобождения гидролитических ферментов и облегчить последующие операции по разделению мембран.
Для разрушения клеток, имеющих стенку, требуются более жесткие методы. Иногда перед разрушением клеток их сначала обрабатывают ферментами, расщепляющими компоненты клеточной стенки, чтобы облегчить ее последующее разрушение. Так, например, для разрушения клеток Е. coli используют обработку буфером трис-ЭДТА и лизоцимом. Более жесткие приемы предусматривают растирание клеток, обработку их ультразвуком и экструзию. Растирание обычно проводят в присутствии различных абразивных материалов - песка, окиси алюминия или стеклянных шариков. Малые объемы материала можно растирать в ступке с помощью пестика, но для больших объемов следует использовать специальные механические приспособления. Бактериальные клетки часто разрушают с помощью ультразвука. Полагают, что в этом случае разрушение происходит под действием сдвиговых усилий, возникающих в результате кавитации. Такие же усилия возникают при продавливании суспензии клеток через небольшое отверстие, например при разрушении клеток с помощью пресса Френча. Существует много разновидностей перечисленных методов, и их выбор зависит от особенностей той мембранной системы, которая подлежит изучению.
Следует отметить, что получаемые при разрушении клеток мембранные фрагменты обычно спонтанно образуют везикулы. В качестве примера можно привести:
1) микросомы, получаемые из плазматической мембраны, эндоплазматического ретикулума или специализированных систем, таких, как саркоплазматическая мембрана;
2) субмитохондриальные частицы из внутренней митохондриальной мембраны;
3) синаптосомы, образующиеся при отрыве нервных окончаний в области синаптических контактов;
4) бактериальные мембранные везикулы, образующиеся из плазматической мембраны Е. coli. Везикулы образуются и из других мембранных систем, например из мембран аппарата Гольджи. Их размер в большинстве случаев сильно зависит от метода разрушения клеток. Это особенно важно, поскольку размеры везикул в значительной степени определяют скорость их седиментации при центрифугировании и их поведение на следующих стадиях очистки мембран. Некоторые мембраны не образуют везикул, в частности мембраны боковых поверхностей соприкасающихся друг с другом животных клеток. При разрушении таких клеток происходит отрыв пары смежных мембранных фрагментов, удерживаемых вместе областью контакта. Наличие таких контактов предотвращает замыкание фрагментов в везикулы, поэтому мембраны выделяются в виде пластин или лентообразных структур.
Большое значение при разрушении клеток имеет также правильный выбор среды. Например, чтобы сохранить замкнутость мембранных органелл, следует использовать такую среду, которая изоосмотична их внутреннему содержимому. Чаще всего для этого используют раствор сахарозы в концентрации 0,25-0,30 М. В ряде случаев лучше использовать сорбитол и маннитол. Следует отметить, что сохранение изотоничности играет важную роль и на последующих стадиях препаративного выделения интактных органелл.
4.2 Разделение мембран
В настоящее время для разделения мембран чаще всего применяют центрифугирование. Мембранные частицы можно разделить по скорости их седиментации или по плавучей плотности. Первый метод называется зональным центрифугированием, и разделение происходит в соответствии со значениями S, а второй - изопикническим центрифугированием, и разделение происходит в условиях равновесной плотности. На практике обычно применяют некий гибрид этих двух методов. На рис.1.7 показано положение некоторых субклеточных единиц на координантной плоскости "S-g".
По оси абсцисс отложены коэффициенты седиментации частиц, а по оси ординат - плотность.

Принцип разделения по скорости седиментации можно легко уяснить, сравнив значения S для разных фракций. Например, ядра имеют относительно высокие значения S, т.е. скорость их седиментации значительно выше, чем у большинства других субклеточных органелл. Ядра можно избирательно осадить центрифугированием клеточного гомогената, при этом все другие органеллы останутся в надосадочной жидкости. В то же время гладкий и шероховатый эндоплазматический ретикулум не удается разделить с помощью зонального центрифугирования.
Для выделения различных мембранных фракций из клеточного гомогената часто используют различия в их плотности. С этой целью проводят центрифугирование в градиенте плотности. Чаще всего для создания градиента плотности используют сахарозу, однако этот метод имеет серьезные недостатки. Чтобы получить плотность, требуемую для разделения различных мембранных фракций, необходимо готовить растворы с высокой концентрацией сахарозы, которые обладают высокой вязкостью и к тому же являются гипертоничными. Внесение субклеточных органелл в гипертоничный раствор сахарозы приводит к их дегидратации, а последующее доведение раствора до изотонических условий часто сопровождается лизисом и повреждением органелл. Другая проблема состоит в том, что многие мембранные органеллы проницаемы для сахарозы. Это также может привести к осмотическому разрушению органелл. Проникновение сахарозы в разделяемые мембранные органеллы может изменить их эффективную плотность.
Таблица 1.1. Физические время все чаще используют другие среды для создания градиента плотности. Некоторые из этих сред перечислены в табл.1.1
Чтобы решить эти проблемы, в последнее свойства градиентных сред.
1. Фиколл. Высокомолекулярный гидрофильный полимер сахарозы, который можно использовать для получения растворов С"Плотностью вплоть до 1,2 г/мл. Основное его преимущество состоит в низком осмотическом давлении растворов по сравнению с растворами с эквивалентной концентрацией сахарозы. Благодаря этому можно создавать растворы, изотоничные во всем диапазоне концентраций благодаря дополнительному включению в среду сахарозы или приемлемых с физиологической точки зрения солей. Недостатками являются высокая вязкость получаемых растворов и существенно нелинейная зависимость вязкости и осмолярности от концентрации.
2. Метризамид. Трииодзамещенный бензамид глюкозы Растворы метризамида имеют большую плотность, чем расторы фиколла при тех же концентрациях. Основным преимуществом растворов метризамида является их очень низкая вязкость, что позволяет ускорить разделение.35% -ный раствор метризамида имеет почти физиологическую осмолярность, так что большую часть операций в ходе разделения мембран можно проводить, не подвергая их действию гипертоничных растворов. Метризоат натрия - родственное метризамиду соединение с близкими свойствами, с тем лишь отличием, что его раствор является изотоничным при концентрации около 20%. Метризоат натрия ис- пользуют прежде всего для выделения интактных клеток. Найкоденз также является производным трииодбензойной кислоты, но имеет три гидрофильные боковые цепи. При центрифугировании он быстро образует свой собственный градиент плотности; используется для выделения субклеточных органелл.
Перколл. Коллоидная суспензия силикагеля, частички которого покрыты поливинилпирролидоном. Это покрытие ослабляет токсическое влияние силикагеля. Основным преимуществом перколла является то, что он не проникает через биологические мембраны, а его растворы имеют низкую вязкость и низкую осмолярность. Вследствие большого размера частиц центрифугирование раствора перколла при умеренных скоростях приводит к формированию градиента плотности. Поэтому разделение обычно происходит очень быстро. Среда, используемая для центрифугирования, может быть изотоничной по всему объему благодаря включению в нее солей или сахарозы. Не составляет труда создать пологий градиент, что позволяет проводить весьма эффективное разделение мембранных фракций по их плавучей плотности.
Сорбитол и маннитол. Эти вещества иногда используют вместо сахарозы, поскольку они, судя по опубликованным данным, проникают через некоторые биологические мембраны хуже, чем сахароза.
Заметим, что глицерол не используется для создания градиента плотности, поскольку с его помощью не удается достичь достаточно высоких значений плотности. Соли щелочных металлов, например CsCl, используют только тогда, когда необходимы растворы с высокой плотностью. Но при этом следует иметь в виду, что в концентрациях, требуемых для создания равновесной плотности, эти соли часто оказывают повреждающее действие на мембранные органеллы.
Для выделения мембран из клеточных гомогенатов используются и другие методы, хотя и не так часто, как центрифугирование.
1. Фазовое распределение. В этом случае разделение мембранных частиц происходит в соответствии с их поверхностными свойствами. С этой целью формируют два несмешивающихся слоя водных растворов различных водорастворимых полимеров. В качестве примера можно привести смеси полиэтиленгликольдекстран и декстранфиколл. Мембранные частицы разделяются в соответствии с их сродством к этим фазам. Последние можно подбирать так, чтобы разделять мембраны по их поверхностному заряду или гидрофобности.
Непрерывный электрофорез в свободном потоке. В этом случае разделение частиц происходит в соответствии с их электрическим зарядом. Разделяемый препарат непрерывно вводят в тонкий слой буфера, стекающего по вертикальной стенке. При этом перпендикулярно направлению потока прикладывают электрическое поле. Таким образом, электрофоретическое разделение частиц происходит поперек стекающего буфера, который собирается на дне камеры в виде отдельных фракций.
Аффинная адсорбция. Разделение основано на биоспецифическом взаимодействии между мембранными компонентами и твердой фазой. С открытием моноклональных антител появилась возможность создания препаративных методик, основанных на использовании специфических антигенных компонентов для выделения мембран. Полученные антитела можно ковалентно присоединять к твердому носителю и с их помощью осуществлять специфическое связывание соответствующих мембран. Чаще всего этот метод используется для выделения мембранных белков. Одна из возникающих здесь проблем связана с подбором таких условий элюирования мембран, которые не вызывали бы денатурации белков.
Метод, основанный на использовании микрогранул силикагеля. Обычно на долю плазматических мембран приходится не более 1°7о общей массы всех мембран эукариотических клеток. Поэтому выделение абсолютно чистых плазматических мембран сопряжено с большими трудностями. Один из подходов, который разработан специально для выделения плазматических мембран, основан на использовании катионизированных микрогранул селикагеля. Эти гранулы прочно адсорбируются на наружной поверхности плазматической мембраны интактных клеток, и фракция плазматических мембран, связанных с гранулами, легко отделяется в градиенте плотности сахарозы от других мембран за счет более высокой плотности гранул. Особенностью этого метода является то, что в получаемом препарате плазматическая мембрана своей внутренней поверхностью обращена в раствор.
4.3 Критерии чистоты мембранных фракций
Пожалуй, наиболее объективным критерием чистоты выделенной мембранной фракции является присутствие в ней какого-либо уникального компонента, который содержится только в этой мембране или является в ней преобладающим. Обычно такими компонентами служат ферменты, которые в данном случае называют маркерами. Список маркерных ферментов, которые используются для контроля чистоты мембранных фракций, приведен в табл.1.2 При определении активности фермента следует принимать во внимание, что он может находиться в латентной форме, например благодаря тому, что локализуется на внутренней поверхности выделяемых мембранных везикул. Другие проблемы, связанные с оценкой чистоты выделенных мембран, рассмотрены в обзоре. Следует отметить, что рекомендуемые методы в большинстве случаев достаточно хорошо отработаны и стандартизованы.
В ряде случаев более удобными мембранными маркерами являются не ферменты, а специфические рецепторы лектинов, гормонов, токсинов или антител. Если изучаемые системы хорошо охарактеризованы, то о чистоте мембранной фракции можно судить по ее белковому составу, определяемому с помощью электрофореза в полиак-риламидном геле в присутствии додецилсульфата натрия. Например, наружная мембрана грамотрицательных бактерий имеет характерный набор полипептидов, которых нет в цитоплазматической мембране.
Таблица 1.2 Маркеры, используемые для контроля чистоты мембранных фракций, выделяемых из клеток млекопитающих "
| Мембранная фракция | Маркерный фермент |
| Плазматические мембраны | 5 "-Нуклеотидаза |
| Щелочная фосфодиэстераза | |
| Na */К + -АТРаза (базолатераль- |
|
| ная мембрана эпителиальных | |
| клеток) | |
| Аденилатциклаза (базальная | |
| мембрана гепатоцитов) | |
| Аминопептидаза (мембрана | |
| щеточной каемки эпителия) | |
| Митохондрии (внутренняя | Цитохром с-оксидаза |
| мембрана) | Сукцинат-цитохром с-оксидо- |
| редуктаза | |
| Митохондрии (наружная | Моноаминооксидаза |
| мембрана) | |
| Лизосомы | Кислая фосфатаза |
| 0-Галактозндаза | |
| Пероксисомы | Каталаза |
| Уратоксидаза | |
| Оксидаза D-аминокислот | |
| Мембраны аппрата | Галактозилтрансфераза |
| Гольджи | |
| Эндоплазматический | Глюкозо-6-фосфатаза |
| ретикулум | Холинфосфотрансфераза |
| NADPH-цитохром с-оксидо- | |
| редуктаза | |
| Цитозоль | Лактатдегидрогеназа |
К другим критериям, по которым можно судить о чистоте мембран, относятся их морфология, выявляемая с помощью электронной микроскопии, и особенности химического состава. Например, фракции, представляющие плазматическую мембрану, аппарат Гольджи или митохондрии, можно идентифицировать по их морфологии. В некоторых случаях препарат характеризуют по содержанию в нем холестерола. Например, в мембранах митохондрии содержится гораздо меньше холестерола, чем в мембранах аппарата Гольджи и плазматических мембранах.
Молекул детергента приходится на одну мицеллу. В мембранных исследованиях используют довольно ограниченный круг детергентов. В табл. 1 представлены те из них, которые чаще всего применяются для солюбилизации и реконструкции мембран. Для этих детергентов характерны довольно высокие значения ККМ (10- 4-10- 2 М) и то, что они относятся к разряду так называемых мягких детергентов, то есть таких, ...

Формирование бислоя является особым свойством молекул липидов и реализуется даже вне клетки. Важнейшие свойства бислоя: - способность к самосборке - текучесть - ассиметричность. 1.2. Хотя основные свойства биологических мембран определяются свойствами липидного бислоя, но большинство спецефических функций обеспечивается мембранными белками. Большинство из них пронизывают бислой в виде одиночной...
Липосомы, или фосфолипидные везикулы (пузырьки), получают обычно при набухании сухих фосфолипидов в воде или при впрыскивании раствора липидов в воду. При этом происходит самосборка бимолекулярной липидной мембраны. Минимуму энергии Гиббса отвечает замкнутая сферическая одно-ламеллярная форма мембраны. При этом все неполярные гидрофобные хвосты находятся внутри мембраны и ни один из них не соприкасается с полярными молекулами воды (рис. 1.11). Однако чаще получаются несферические многоламеллярные липосомы, состоящие из нескольких бимолекулярных слоев, - многослойные липосомы.
Рис. 1.11. Схема строения однослойной липосомы
Отдельные бимолекулярные слои многослойной липосомы отделены водной средой. Толщина липидных слоев составляет, в зависимости от природы липидов, 6,5 - 7,5 нм, а расстояние между ними - 1,5 - 2 нм. Диаметр многослойных липосом колеблется в пределах от 60 нм до 400 нм и более.
Однослойные липосомы можно получить различными методами, например из суспензии многослойных липосом, если обработать их ультразвуком. Диаметр однослойных липосом, полученных этим методом, составляет 25-30 нм. Разработаны и другие методы получения однослойных липосом, в том числе диаметром до 400 нм и более.
Липосомы представляют собой в некотором роде прообраз клетки. Они служат моделью для исследований различных свойств клеточных мембран.
Липосомы нашли непосредственное применение в медицине. Например, можно заключить внутрь липосом лекарственный препарат и использовать как фосфолипидную микрокапсулу для доставки лекарства в определенные органы и ткани. Липосомы не токсичны (при правильном подборе липидов), полностью усваиваются организмом, способны преодолевать некоторые биологические барьеры. Так, инсулин, заключенный в липосому, защищен от действия пищеварительных ферментов. В настоящее время выясняется возможность вводить этот препарат в липосомах перорально, что может избавить больных диабетом от необходимости систематических уколов. Проводятся работы по разработке методов липосомальной терапии опухолей, ферментативной недостаточности, атеросклероза. Изучается возможность прицельной доставки лекарственного препарата, заключенного в липосомах, к больному органу или даже к больному участку (в частности, к пораженному участку сердца).
Для этого к липосоме присоединяется белковая молекула -антитело к соответствующему мембранному антигену органа-мишени. Липосомы с током крови разносятся по всему организму и задерживаются, оказавшись около органа-мишени.
Несмотря на заманчивые перспективы липосомальной терапии, еще имеется достаточно много нерешенных вопросов.
Рис. 1.12. Образование плоской бислойной липидной мембраны
Плоские бислойные липидные мембраны (БЛМ) - другой тип модельных мембран. Такие мембраны получают на маленьких отверстиях диаметром около 1 мм в пластинке из пластика (например, фторопласта), погруженной в водную среду. На отверстие наносят каплю раствора липида (в спирте,) хлороформе, гептане или других растворителях). Растворитель диффундирует из раствора в воду, и на отверстии остается пленка липида. Эта пленка спонтанно утончается до тех пор, пока не образуется бимолекулярный слой толщиной около 6 нм. Лишний липид собирается в виде ободка-торуса у краев отверстия (рис. 1.12).
Плоские липидные мембраны, наряду с липосомами, широко используются в качестве моделей для изучения электрических свойств мембраны, их проницаемости и других научных исследований. С помощью модельных мембран изучаютряд функций биологических мембран, а том числе, барьерную (например, селективность проницаемости - хорошую проницаемость для воды и плохую для ионов). Можно моделировать биологический транспорт, вводя в модельную мембрану молекулы-переносчики.
контрольные вопросы, задачи, задания
1. Удельная электрическая емкость мембраны аксона, измеренная внутриклеточным микроэлектродом, оказалась равной 0,5 микрофарад/см 2 . По формуле плоского конденсатора оценить толщину гидрофобного слоя мембраны с диэлектрическойпроницаемостью 2.
2. Какое расстояние на поверхности мембраны эритроцита проходит молекула фосфолипида за 1 секунду в результате латеральной диффузии? Коэффициент латеральной диффузии принять равным 10~ 12 м 2 /с. Сравните с окружностью эритроцита диаметром 8 мкм.
3. При фазовом переходе мембранных фосфолипидов из жидкокристаллического состояния в гель толщина бислоя изменяется. Как при этом изменится электрическая емкость мембраны? Как изменится напряженность электрического поля в мембране?
4. С помощью спин-меченых молекул фосфолипидов установлен градиент вязкости по толщине мембраны. Опишите эксперимент. Где вязкость выше: у поверхности мембраны или в ее центре?
типовые тесты текущего контроля
1.1. Толщина биологической мембраны:
1. 10 А 3.0,1 мкм
2. 10 нм 4. 10 мкм
1.2. Жидкостно-мозаичная модель биологической мембраны включает в себя:
1. белковый слой, полисахариды и поверхностные липиды!
2. липидный монослой и холестерин
3. липидный бислой, белки, микрофиламенты
4. липидный бислой
1.3. Липидная часть биологической мембраны находится в следующем физическом состоянии:
1. жидком аморфном
2. твердом кристаллическом
3. твердом аморфном
4. жидкокристаллическом
1.4. Удельная электрическая емкость мембраны аксона:
1. 0,5 10 -4 Ф/м 2 3. 0,5 10 -2 Ф/см 2
2. 0,5 Ю -2 Ф/м 2 4. 0,5 10 -12 Ф/м 2
1.5. Характерное время переноса молекулы фосфолипидоф из одного положения равновесия в другое при их диффузии:
латеральная флип-флоп
1. 10 -7 – 10 -8 ~1 час
2. 10 -10 – 10 -12 10 -7 – 10 -8 с
3. 1 – 2 часа 10 – 50 с
1.6. Фазовый переход липидного бислоя мембран из жидкокристаллического состояния в гель сопровождается:
1. утоныпением мембраны
2. толщина мембраны не меняется
3. утолщением мембраны
ГЛАВА 2. ТРАНСПОРТ ВЕЩЕСТВ ЧЕРЕЗ БИОЛОГИЧЕСКИЕ МЕМБРАНЫ
Живые системы на всех уровнях организации - открытые системы. Поэтому транспорт веществ через биологические мембраны - необходимое условие жизни. С переносом веществ через мембраны связаны процессы метаболизма клетки, биоэнергетические процессы, образование биопотенциалов, генерация нервного импульса и др. Нарушение транспорта веществ через биомембраны приводит к различным патологиям. Лечение часто связано с проникновением лекарств через клеточные мембраны. Эффективность лекарственного препарата в значительной степени зависит от проницаемости для него мембраны.
Большое значение для описания транспорта веществ имеет понятие электрохимического потенциала.
Химическим потенциалом данного вещества μ к называется величина, численно равная энергии Гиббса, приходящаяся на один моль этого вещества. Математически химический потенциал определяется как частная производная от энергии Гиббса G по количеству k-ro вещества, при постоянстве температуры Т, давления Р и количеств всех других веществ m 1 (l≠k):
Для разбавленного раствора концентрации вещества С:
где μ Q - стандартный химический потенциал, численно равный химическому потенциалу данного вещества при его концентрации 1 моль/л в растворе.
Электрохимический потенциал μ - величина, численно равная энергии Гиббса G на один моль данного вещества, помещенного в электрическом поле.
Для разбавленных растворов
где F = 96500 Кл/моль - число Фарадея, Z - заряд иона электролита (в элементарных единицах заряда), φ- потенциал электрического поля, Т [К] - температура.
Транспорт веществ через биологические мембраны можно разделить на два основных типа: пассивный и активный.
1.Опыты Пфефера, Харди-Фишера, Овертона. Природа клеточной мембраны и альтернатива клеточной мембране.
2. Метод флуоресцентных зондов при изучении клеточных мембран.
3.Удельная электрическая емкость мембраны аксона, измеренная внутриклеточным электродом, оказалась равной 0,5 мкф/см 2 . по формуле плоского конденсатора определить толщину гидрофобного слоя мембраны. Ε липидов считать равной 2.
4.Механизм генерации потенциала действия кардиомицета.
5.Метод спиновых зондов в изученни клеточных мембран.
6. Какое расстояние на поверхности мембраны эритроцита проходит молекула фосфолипида за 1 секунду в результате латеральной диффузии? Коэффициент латеральной диффузии принять равным 10 -12 м 2 /с. сравнить с окружностью эритроцита диаметром 8 мкм.
7.Структура ионного канала.
8.Метод дифференциальной микрокалориметрии.
9.При фазовом переходе мембранных фосфолипидов из жидкокристаллического сосотояния в гель тольщина бислоя изменяется. Как при этом изменится электрическая емкость мембраны?
10.Ионные каналы клеточных мембран.
11.Рентгеноструктурный анализ при изучении клеточных мембран. Принципы и примеры.
12. При фазовом переходе мембранных фосфолипидов из жидкокристаллического состояния в гель толщина бислоя изменяется. Как при этом изменится напряженность электрического поля в мембране?.
13.Ионные токи в аксоне. Модель Ходжкина-Хаксли.
14.Методы изучения проницаемости мембран.
15. С помощью спин-меченных молекул фосфолипидов установлен градиент вязкости в мембране по толщине. Опишите эксперимент.
16.Механизм генарции потенциала действия.
17.Применение кондуктометрии при изучении мембран. Опыты Фрике.
18. Где вязкость гидрофобного слоя выше: у поверхности мембраны или в ее толщине. Как это установлено?
19.Распространения нервного импульса вдоль возбудимого волокна.
20.Электрокинетические явления в клетках и суспензиях.
21. Как изменится облегченная диффузия ионов калия с участием молекулы валиномицина после фазового перехода мембранных липидов из жидкокристаллического состояния в гель?
22.Потенциал действия. физический механизм.
23.Электросмос в живых клетках и тканях.
24.Будет ли наблюдаться осмотический эффект (набухание в гипотоническом и сморщивание в гипертоническом растворах) при накоплении ионов натрия по схеме антипорта?
25.Потенциал покоя. Его природа.
26. Природа осмоса в живых клетках.
27. Будет ли наблюдаться осмотический эффект (набухание в гипотоническом и сморщивание в гипертоническом растворах) при накоплении ионов натрия по схеме симпорта?
28.Природа биоэлектрических потенциалов.
29.Клетка как осмометр. Пример определения изотоничности раствора с использованием живых клеток.
30.Показать, что уравнение Нернста-Планка сводится к уравнению Фика для случая диффузии незаряженных частиц.
31.Различия белковых каналов и липидных пор.
32.Природа оседания мертвых клеток. Физ.хим осонвы метода СОЭ.
33. Фермент Na + -K + - АТФаза в плазматической мембране эритроцита совершил шесть циклов. Какое количество ионов натрия и калия при этом было активно транспортировано? Сколько энергии было при этом израсходовано, если гидролиз одного моля АТФ сопровождается освобождением 33,6кДж?. КПД сопряжения считать равным 100%.
34.механизм проницаемости мембран для молекул воды. Гипотеза кинков.
35.ЯМР-спектроскопия при исследованиях мембран. Примеры и принципы.
36. в клеточных мембранах известно три ионных насоса натрий-калиевый, протонный, кальциевый. Каким образом осуществляется при этом активный транспорт сахара и аминокислот?
37.модель формирования поры при фазовом переходе.
38.методы измерения микровязкости в мембранах.
39. возможен ли одновременный трансмембранный перенос ионов калия и натрия по схеме симпорта?
40.электрический пробой мембранных липидов.
42.методы спектральных зондов.
43. возможен ли одновременный трансмембранный перенос ионов калия и натрия по схеме антипорта?
44.модель критической липидной поры.
45.применение ион-селективных электродов при исследованиях проницаемости мембран.
46. возможен ли одновременный трансмембранный перенос ионов калия и натрия по схеме унипорта?
47.липидные поры в свете стабильности мембран.
48. методы эритрограмм. Их информационная ценность.
49. какой транспорт ионов создает мембранную разность потенциалов: пассивный или активный?
50.механизм и закономерности вторичного активного транспорта ионов.
51. экспериментальные критерии облегченной диффузии.
52. что больше скорость распространения электрического сигнала по проводам морского телеграфа или скорость распространения нервного импульса по мебране аксона? Почему?
53. Электрогенные ионные насосы.
54. Методы фракционирования клетки.
55. Каков биофизический механизм действия местного анестетика тетрэиламмония?
56. Опыт и схема Уссинга.
57. Природа сил липид-липидного взаимодействия в мембране. Методы исследования.
Календарный тематический план по дисциплине
«Молекулярная организация биологических мембран»
2011/2012 уч. год (4 курс, 7 семестр ВБФ биофизики)
| дата | № п/п | Тип и название учебного модуля | Учебно-методическое обеспечение учебного модуля |
| ЛЕКЦИИ: | |||
| Биологические мембpаны как унивеpсальные стpуктуpно-функциональные обpазования живых систем. | Конспект лекции. | ||
| Стpуктуpная оpганизация биомембpан. | Конспект лекции. | ||
| Белки и липиды мембран. | Конспект лекции. | ||
| Белок-липидные взаимодействия. | Конспект лекции. | ||
| Динамические свойства мембран. | Конспект лекции. | ||
| Моделирование структуры мембран. | Конспект лекции. | ||
| Pасчеты стpуктуpы мембpан | Конспект лекции. | ||
| ИТОГО – 14 часов | |||
| Практические занятия * | |||
| Расчеты электрической емкости и импеданса мембран. | Компьютерный класс кафедры. | ||
| Определение толщины мембраны эритроцита по электропроводности. | Компьютерный класс кафедры. | ||
| Исследование механической прочности мембран эритроцитов. | Компьютерный класс кафедры. | ||
| Исследование влияния холестерола на деформируемость мембран эритроцитов. | Компьютерный класс кафедры. | ||
| Расчеты прочности мембран эритроцитов. | Компьютерный класс кафедры. | ||
| Исследование действия магнитного поля на механические свойства мембран эритроциов | Компьютерный класс кафедры. | ||
| Итого – 22 часа |
* - каждое практическое занятие рассчитано на 4 часа.
Утв. на заседании кафедры _____________________________________________
Кровь и эритроциты. Продолжаем публикацию материалов о крови.
Как выглядит эритроцит? При нормальных физиологических условиях в кровяном русле эритроциты имеют двояковогнутую форму с равномерными утолщениями по краям и с центральной более светлой частью – пэллором.
При светооптическом исследовании рутинно окрашенный кислыми красителями нормальный эритроцит имеет форму диска диаметром 6,9-7,7 и до 9,0 мкм. В зависимости от размеров эритроциты подразделяются на микро- и макроциты, но основная масса их представлена нормоцитами/дискоцитами.
Морфофункционалъные свойства эритроцита
Эритроцит – безъядерная двояковогнутая клетка средним объемом 90,0 мкм 3 и площадью 142 мкм 2 . Наибольшая толщина его 2,4 мкм, минимальная – 1 мкм.
В высушенном препарате средний размер эритроцита равен 7,55 мкм; 95% его сухого вещества приходится на железосодержащий белок гемоглобин и лишь 5 % – на долю других веществ (другие белки и липиды). Такие клетки представляют абсолютное большинство – свыше 85% – эритроцитов здорового человека.
Ядерные формы эритроцитарного ростка легко отличаются от большинства клеток лейкоцитарного ряда отсутствием в их цитоплазме гранул (ошибки возможны лишь при идентификации бластных клеток). Эритробласты отличаются более гранулированным и плотным ядерным хроматином.
На центральную впадину (пэллор) диска эритроцита приходится от 35 до 55 % его поверхности, и на поперечном срезе эритроцит имеет форму бублика, что с одной стороны, обеспечивает им сохранение гемоглобина и, с другой – позволяет эритроциту проходить даже через самые тонкие капилляры. Имеющиеся к настоящему времени модели строения эритроцита соответствуют представлению о специфических свойствах этой клетки, особенно его оболочки, обеспечивающей, при всей ее чувствительности к деформирующему давлению, противостояние сгибу и возрастанию суммарной поверхности.
Данные литературы свидетельствуют, что размеры и деформируемость мембраны эритроцитов являются их наиважнейшими характеристиками, с которыми связывают нормальное функционирование этих клеток, в том числе высокую миграционную возможность, участие в обменных процессах (в первую очередь – в обмене кислорода).
Изменение микроэластометрических свойств эритроцитов и «преображение» дискоцитов в другие морфологические формы могут вызывать различные агенты. Так, появление поверхностных выростов приводит к уменьшению эластичности мембраны, что, возможно, обусловлено противоположными силами, возникающими в самом процессе деформации эритроцита; деформация усиливается при уменьшении концентрации в клетках АТФ.
Если целостность мембраны клетки нарушается, то эритроцит утрачивает характерную для него форму и превращается в сферопласт, который, в свою очередь, гемолизируется. Структура мембраны эритроцита (дискоцита) одинакова на всем протяжении; и несмотря на то, что впадины и выпуклости могут возникать в ее различных участках, изменения внутри- или внеклеточного давления с разбросом ±15 % не вызывает сморщивания всей клетки, ибо она имеет значительный запас «антидеформабельности». Мембрана эритроцита обладает достаточной эластичностью, чтобы противостоять воздействию разнообразных факторов, возникающих во время циркуляции эритроцита по кровяному руслу.
В состав мембраны эритроцита входят: фосфолипиды (36,3%), сфингомиелины (29,6%), холестерин (22,2%) и гликолипиды (11,9%). Первые два элемента представляют собой амфифильные молекулы в водной среде, формирующие характерный липидный бислой, который к тому же пронизывается интегральными молекулами белков, связанных внутри эритроцита с его цитоскелетом.
Мембранные липиды пребывают в жидком состоянии, обладают незначительной вязкостью (всего в 10-100 раз превышающей вязкость воды). На внешней поверхности мембраны расположены липиды, сиаловая кислота, антигенные олигосахариды, адсорбированные белки; внутренняя поверхность мембраны представлена гликолитическими ферментами, натрием и кальцием, АТФазой, гликопротеинами и гемоглобином.
Двойной липидный слой мембраны выполняет три функции: функцию барьера для ионов и молекул, структурную основу для функционирования рецепторов и ферментов (белков, гликопротеинов, гликолипидов) и механическую. В осуществлении специализированной, дыхательной, функции – переносе кислорода или двуокиси углерода – основную роль играют белки мембраны, «встроенные» в липидный бислой. Зрелые эритроциты не способны к синтезу нуклеиновых кислот и гемоглобина; для них характерен низкий уровень обмена, что обеспечивает достаточно длительный период жизни этих клеток (120 сут).
По мере старения эритроцита площадь его поверхности уменьшается, в то время как содержание гемоглобина остается без изменения. Установлено, что в «зрелом» возрасте эритроциты длительно сохраняют постоянство химического состава, но по мере старения клеток содержание в них химических веществ постепенно понижается. Цитоскелет эритроцита образуется и контролируется мультигенными и ассоциированными с мембраной «семействами» белков, организующих специализированные мембранные домены, поддерживающие функцию и форму этой строго специализированной клетки.
Электрический потенциал эритроцита
Мембрана эритроцита содержит 50% протеина, до 45 % липидов и до 10 % углеводов. На поверхности интактных клеток «сетевое» распределение зарядов определяется гликопротеидом, содержащим сиаловую (нейтраминовую) кислоту, обусловливающую до 62 % поверхностного отрицательного заряда клетки.
Полагают, что каждый электрический заряд соответствует 1 молекуле этой кислоты. Потеря поверхностью эритроцита сиаловой кислоты приводит к понижению его электрофоретической подвижности (ЭФП) и подавлению транспорта катионов. Следовательно, на поверхности клеток существует «мозаика» зарядов, определяемая катионными и анионными группами, соотношение которых и определяет общий электрический заряд эритроцитов.
Для поддержания оптимального состояния гомеостаза форменные элементы крови должны обладать стабильным зарядом. Высокая стабильность ЭФП обеспечивается тонким механизмом ее регуляции – сбалансированности процессов перекисного окисления липидов (ПОЛ) в мембранах эритроцитов и защитного действия антиоксидантной системы.
Эмпирически установлено, что на мембране эритроцитов располагаются рецепторы для антител, и наличие на поверхности даже небольшого их количества может нарушить нормальные физиологические функции в организме и изменить ЭФП эритроцитов. Это может влиять на уровень содержания гемоглобина в последних, поскольку содержание гемоглобина и ЭФП строго скоординировано.
Необходимо также учитывать, что при экстремальных воздействиях на организм негативных факторов продукты перикисного окисления липидов влияют на электрокинетические свойства эритроцитов. В свою очередь, это отражается на скорости протекания перикисных процессов в их мембранах.
Благодаря электростатическому отталкиванию («распору» по Чижевскому) одноименно заряженных клеток эритроцитов последние беспрепятственно движутся по кровеносным сосудам, выполняя свою кислородно-транспортную функцию. Поэтому нарушение стабильности заряда можно считать интегральным показателем патологических сдвигов в организме.